Claim nutrizionali e sulla salute
Quadro generale
In data 17 marzo 2017 è stato pubblicato in Gazzetta Ufficiale (GU Serie Generale n.64 del 17-3-2017) il Decreto legislativo 7 febbraio 2017 che regolamenta la disciplina sanzionatoria per la violazione delle disposizioni contenute nel Regolamento (UE) n.1924/2006 relativo alle indicazioni nutrizionali e sulla salute fornite sui prodotti alimentari, ad oltre 10 anni dalla sua pubblicazione. Infatti anche per le norme emanate a livello europeo, spetta agli Stati membri stabilire le sanzioni applicabili in caso di violazione della normativa sui mangimi e sugli alimenti.
Il decreto prevede che i compiti di vigilanza e controllo sull’adempimento degli obblighi spettino al Ministero della Salute, alle Regioni e Province autonome e alle ASL, secondo gli ambiti di rispettiva competenza. Restano invece di competenza dell’Autorità Garante della Concorrenza e del Mercato (AGCM) le questioni relative a pratiche commerciali scorrette (pubblicità ingannevole) e pubblicità comparativa.
Il decreto consta di 14 articoli e stabilisce le sanzioni amministrative pecuniarie (da 2000 a 40000 €) da applicare in caso di utilizzo di indicazioni nutrizionali e sulla salute non consentite dalla normativa europea e in caso di inadempimento degli obblighi stabiliti dal Regolamento claim.
Il decreto sanzioni prevede inoltre, in caso di violazioni reiterate, la possibilità di inibire lo svolgimento dell’attività fino a 20 giorni.
Va tenuto presente che ai sensi dell’articolo 16 della legge 689/1981 (legge di depenalizzazione), richiamata nei consideranda del Decreto sanzioni, è previsto il pagamento delle sanzioni in misura ridotta entro il termine di sessanta giorni dalla contestazione immediata o, se questa non vi è stata, dalla notificazione degli estremi della violazione. L’importo della sanzione in misura ridotta corrisponde alla terza parte del massimo della sanzione prevista per la violazione commessa o, se più favorevole e qualora sia stabilito il minimo della sanzione edittale, pari al doppio del relativo importo, oltre alle spese del procedimento.
Potrebbe inoltre risultare applicabile in alcune situazioni l’Istituto della diffida di cui al Decreto legge 24 giugno 2014, n.9, che prevede, a fronte di pagamento entro pochi giorni, la possibilità di ottenere un’ulteriore riduzione rispetto alla sanzione in misura ridotta.
Le sanzioni più gravi sono previste nel caso si suggerisca che il mancato consumo di un alimento possa compromettere la salute, si faccia riferimento alla perdita di peso in termini di entità o percentuale, oppure si facciano riferimenti medici.
Il decreto è entrato in vigore in data 1° aprile 2017.
Integratori alimentari
Gli integratori alimentari (come gli alimenti arricchiti di vitamine e minerali) sono prodotti soggetti a notifica al Ministero della Salute. Ai sensi della Circolare 6 marzo 2008, n.4075, l’esame ministeriale dell’etichetta è volto ad accertare l’adeguatezza del prodotto in relazione alla composizione, […] alle proprietà rivendicate e alle indicazioni anche senza rivestire il significato di un esame formale.
Di conseguenza per gli integratori alimentari esiste un controllo sistematico da parte del Ministero della Salute, in quanto Autorità competente. è comunque vero che tali valutazioni di conformità non escludono la rilevanza dei controlli ufficiali sul territorio (ASL, NAS), considerando anche la non formalità dell’esame a livello ministeriale e soprattutto la possibilità che risultino conformi etichette trasmesse molti anni fa, valutate allora e mai adeguate.
Inoltre, considerando anche il registro degli integratori alimentari che evidenzia l’esito favorevole della notifica, sembra necessario un collegamento tra il Ministero a livello centrale e i controllori sul territorio.
In pratica l’autorità locale competente potrà acquisire tutta la documentazione relativa alla notifica (comprese variazioni e/o scambi di comunicazione con il Ministero in merito al prodotto) e, se del caso, aprire con l’ufficio competente un confronto per completare correttamente la valutazione di un claim.
Casi particolarmente spinosi potrebbero essere rappresentati da indicazioni relative ai probiotici, per i quali l’Italia ha voluto identificare diciture che non corrispondono ad indicazioni sulla salute, e per le sostanze e preparati di origine vegetale (botanicals), per i quali le indicazioni sulla salute non sono ancora state esaminate a livello europeo.
Analisi delle sanzioni previste
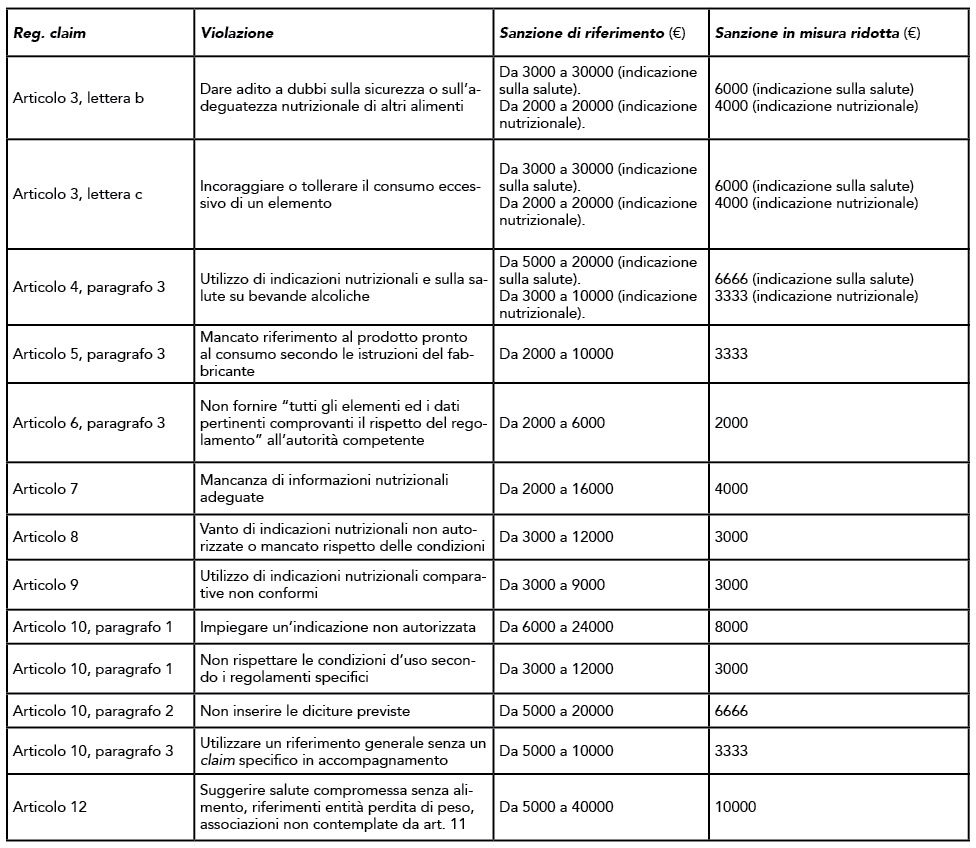
Come anticipato nella sezione introduttiva, il decreto stabilisce sanzioni di diversa entità in base agli inadempimenti agli obblighi previsti dal Regolamento claim.
Si riportano nella tabella seguente: il riferimento all’articolo di cui al Regolamento claim (Reg. 1924/2006), la specifica violazione, la sanzione di riferimento e la sanzione in misura ridotta.