Probiotic 2.0
Probiotic 2.0
Combinazioni ottimali di lievito e batteri per la salute intestinale e orale
Lallemand Health Solutions
Per decenni, due tipi di microrganismi sono stati con successo utilizzati come probiotici: batteri, principalmente della specie Lactobacilli e Bifidobacteria, e lieviti, in particolare Saccharomyces cerevisiae boulardii, che è il probiotico più clinicamente documentato nella storia della medicina. Lieviti e batteri sembrano avere modalità di azione distinte e complementari che aiutano ad equilibrare la microflora intestinale e orale. Probiotic 2.0 di Lallemand Health Solutions è una formulazione probiotica che combina una specifica gamma di ceppi batterici ben documentati con lievito S.boulardii di grado farmaceutico, per un approccio sinergico alla salute intestinale e orale; distribuito in Italia da C.F.M. Co. Farmaceutica Milanese SpA.
 Composizione
Composizione
Probiotic 2.0 combina lievito S.boulardii con una gamma di ceppi batterici Lallemand ben documentati (Tab.1), selezionati per i loro effetti probiotici (effetto barriera, effetto immuno-modulatore, effetto trofico) e modalità di azione complementari. Grazie a questi ceppi possono quindi essere realizzate formulazioni personalizzate.
Studi preclinici: meccanismo di azione
I benefici dei microrganismi probiotici sono legati alle loro proprietà ed alla loro attività metabolica nell’ospite; la loro modalità di azione è ormai sempre più nota. Sono state descritte le attività specifiche e complementari dei probiotici contenenti S.boulardii e batteri lattici. Nell’intestino ad esempio, possiamo dividere l’attività probiotica in tre aree: effetto sul lume intestinale, effetto sulla parete intestinale ed effetto immunomodulatore.
1) Nel lume intestinale l’obiettivo è disattivare o eliminare i potenziali agenti patogeni per prevenirne l’attacco, la colonizzazione e l’attività tossica.
L’effetto luminale dei batteri probiotici è principalmente legato al loro metabolismo, ovvero alla loro produzione di certi antagonisti (es. batteriocine, H2O2), o alla loro induzione di un ambiente acido (produzione di acido lattico), poichè la maggior parte degli agenti patogeni (es. Salmonella, coliformi) è sensibile a bassi pH. Lactobacillus brevis HA-112, Lactobacillus rhamnosus HA-111 e Bifidobacterium infantis Rosell-33 ad esempio, hanno mostrato di esercitare specifiche attività antimicrobiche contro patogeni intestinali come Escherichia coli, Salmonella, Staphylococcus aureus, e Clostridium difficile. Dall’altra parte, S.boulardii ha un effetto luminale differente e ben descritto: esso è in grado di legare specificamente i patogeni ed in particolare E.coli, formando aggregati che possono facilmente “scivolare” nell’intestino. È stata inoltre dimostrata anche la sua capacità di inattivare in modo specifico le tossine A e B di C.difficile (questo batterio che produce tossine è notoriamente responsabile per il 10-25% dei casi di diarrea associata ad antibiotico nei pazienti).
2) A livello della parete intestinale: l’effetto barriera.
I batteri probiotici aderiscono all’epitelio intestinale prevenendo l’adesione di agenti patogeni mediante impedimento sterico (es. Lactobacillus plantarum HA-119 e Bifidobacterium bifidum HA-132 mostrano forte adesione alle cellule epiteliali in vitro). Alcuni batteri agiscono per esclusione competitiva, in concorrenza con gli agenti patogeni per nutrienti o specifici siti di adesione. È stato ad esempio chiaramente mostrato che le proteine dello strato di superficie di Lactobacillus helveticus Rosell-52 prevengono l’adesione di E.coli alle cellule intestinali e migliorano la funzione barriera intestinale. Altri effetti barriera includono la stimolazione della produzione di muco: L.rhamnosus Rosell-11 è in grado di stimolare la produzione di mucina da parte delle cellule epiteliali, migliorando la protezione epiteliale. L.helveticus Rosell-52 è anche in grado di rinforzare la barriera intestinale rafforzando le giunzioni occludenti fra cellule epiteliali, riducendo così l’infiltrazione dei patogeni (1). S.boulardii è in grado di comunicare con gli enterociti aiutandoli a preservare la loro integrità ed il normale metabolismo (effetto trofico). Inoltre, sebbene non in grado di aderire al rivestimento dell’intestino, questo lievito probiotico mostra anche un effetto positivo sulle giunzioni occludenti delle cellule epiteliali.
3) Effetto immunomodulatore: oltre la superficie intestinale, lieviti e batteri probiotici possono contribuire al sistema di difesa dell’organismo. L’interazione dei probiotici con il sistema immunitario è sempre più documentata. L.rhamnosus Rosell-11, Bifidobacterium longum Rosell-175 e Bifidobacterium lactis LAFTI B94, ad esempio, possono modulare la produzione di citochine, ovvero i messangers del sistema immunitario. S.boulardii possiede anche un documentato effetto anti-infiammatorio.
La digestione inizia nella bocca
L’intestino è il principale sito di azione dei probiotici, ma non l’unico. Quando si assume un approccio olistico e più ampio alla salute digestiva, la bocca deve essere tenuta in considerazione come primo sito di digestione.
La bocca infatti, possiede un ecosistema microbico ricco e complesso, il cui squilibrio può condurre a gengiviti, infezioni ai denti e patologie correlate (carie, gengiviti, alitosi, etc, sono tutte condizioni che si associano a batteri indesiderati). Sono oltre 700 le specie batteriche differenti identificate nella bocca; il 20% di queste appartiene al genere Streptococcus. I probiotici possono contribuire alla salute orale equilibrando questo ecosistema microbico. Sebbene la convalida clinica dell’efficacia dei probiotici nella salute orale sia ancora agli albori, numerosi studi confermano i benefici di alcuni probiotici nella prevenzione di candidosi orale, carie, alitosi e gengiviti.
L’effetto e la modalità di azione dei probiotici può anche aiutare ad equilibrare l’ecosistema microbico della bocca. In particolare, Streptococcus mutans, naturalmente presente nei soggetti sani, è stato identificato come batterio cariogenico chiave; lo squilibrio della microflora della bocca può condurre alla proliferazione di questo batterio, contribuendo così alla formazione di carie. Alcuni ceppi di Lactobacillus, come L.rhamnosus Rosell-11, L.helveticus Rosell-52, L.rhamnosus HA-111, L.brevis HA-112, L.salivarius HA-118, e L.fermentum HA-179, si sono mostrati in grado di inibire la crescita di S. mutans, in vitro.
Ceppi batterici del portfolio Lallemand Health Solutions sono stati caratterizzati e sottoposti a screening per la loro capacità di produrre H2O2, che notoriamente inibisce la crescita di agenti patogeni. L.reuteri HA-188 e L.helveticus Rosell-52 sono produttori di H2O2, ed offrono quindi un grande potenziale in termini di salute orale.
Cosa dire a proposito di lievito e salute orale? L’effetto anti-infiammatorio provato di S.boulardii è di grande interesse nella prevenzione, ad esempio, dell’infiammazione orale (gengivite). Questi dati, nel loro insieme, supportano la combinazione di ceppi di batteri probiotici e lieviti specificatamente selezionati per la salute intestinale ed orale.
Una sinergia comprovata
Lieviti e batteri hanno diverse proprietà e modalità di azione che conferiscono benefici clinici in termini di salute intestinale. Da qui nasce l’idea che la combinazione di questi possa condurre ad effetti sinergici: è nato così Probiotic 2.0! Questa idea è stata testata dal Prof. Bisson nell’ambito di uno studio preclinico, in un modello murino di diarrea del viaggiatore (challenge sperimentale E.coli 055:B5) (2). La formula Probiotic 2.0 (commercializzata come Protecflor) combinava lievito S.boulardii con tre ceppi di batteri probiotici ben documentati: L.rhamnosus Rosell-11, L.helveticus Rosell-52, e B.longum Rosell-175, selezionati per le loro complementari modalità di azione.
Questo studio mostrava che la combinazione Probiotic 2.0 offriva una migliore protezione contro l’infezione da E.coli rispetto al lievito probiotico o alla miscela di batteri da soli: i sintomi dell’infezione da E.coli (febbre, perdita di peso, diarrea) potevano in questo modo essere controllati in modo più efficace rispetto a quanto osservato con lievito e batteri da soli. Un effetto sinergico di lievito e batteri è stato osservato anche a livello immunitario, indicando così un effetto anti-infiammatorio. Le citochine anti-infiammatorie (IL-10 e IL-4) risultavano significativamente aumentate, mentre, nello stesso modello, le citochine pro-infiammatorie (IL 1-α, IL 1-β, IL 2, IL 6, GM-CSF, IFN-γ, TNF-α) risultavano inferiori al placebo, a S.boulardii, o al solo batterio. Alcuni Autori suggeriscono che i lieviti possono interagire positivamente con i batteri probiotici, promuovendone la sopravvivenza e stimolandone la crescita. L’interazione positiva potrebbe essere dovuta alla produzione di nutrienti come peptidi, aminoacidi e vitamine.
 Studi clinici
Studi clinici
La formula Probiotic 2.0 testata da Bisson nel ratto è stata commercializzata con successo in diversi paesi con diversi nomi commerciali e sono state pubblicate numerose sperimentazioni cliniche post-commercializzazione.
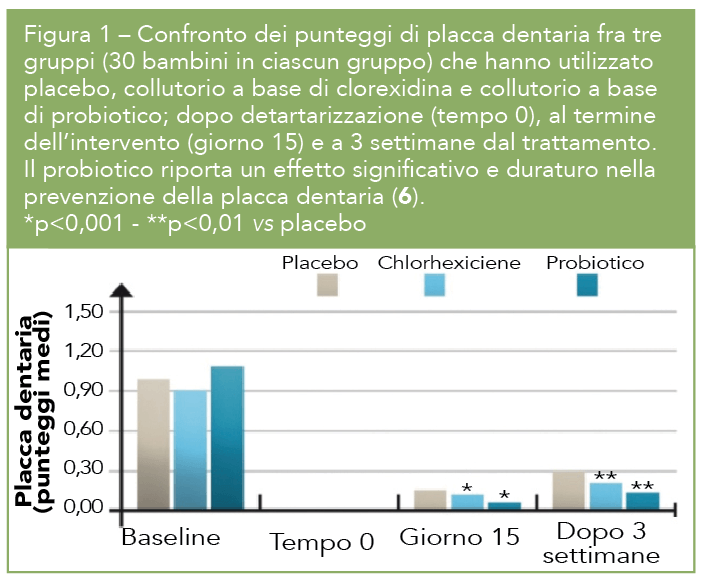
Una prima sperimentazione, condotta da Grandy et al in Bolivia in bambini ospedalizzati per diarrea acuta da rotavirus, ha mostrato che una formula combinata (S.boulardii, L.rhamnosus Rosell-11, L.helveticus Rosell-52, e B.longum Rosell-175 – nome commericale Darolac) abbreviava la durata della diarrea di 24 ore e quindi il tempo di escrezione del rotavirus, riducendo così anche il rischio di trasmissione ad altri bambini (3). Altri studi con la stessa combinazione, commercializzata come Oralis SB, hanno esaminato l’equilibrio della microflora orale. Questa combinazione probiotica, utilizzata come collutorio, riduce significativamente la presenza nella saliva del batterio cariogenico S.mutans nei bambini rispetto al placebo (4), ed anche negli adulti, sempre rispetto al placebo (5) e con efficacia similare ai collutori a base di clorexidina e floruro di sodio. Il probiotico è più efficace del placebo e dei tradizionali collutori antisettici nel ridurre la formazione della placca ed il rischio di gengiviti nei bambini (6,7) (Fig.1).
Sicurezza
Tutti i ceppi del portfolio Lallemand Health Solutions sono caratterizzati e documentati per quanto concerne la sicurezza. Tutti i ceppi sono oggetto di screening per la presenza di oltre 350 geni antibiotico-resistenti. Inoltre, ciascun ceppo è oggetto di screening per la presenza di fattori di virulenza e geni codificanti enterotossine. Inoltre, gli studi clinici sopracitati dimostrano la sicurezza della combinazione Oralis SB/Darolac. Altri ceppi del portfolio Probiotic 2.0 sono anch’essi clinicamente documentati sia individualmente che, talvolta, in combinazione. La Tabella 2 riporta il numero di studi clinici per questi ceppi.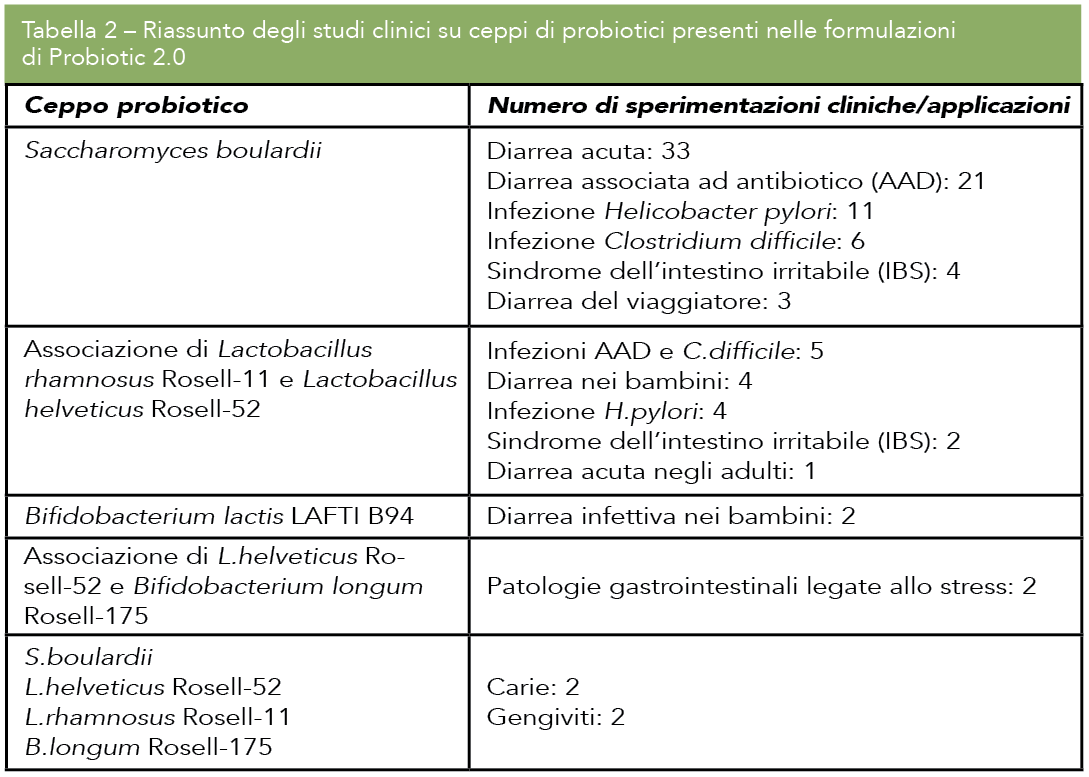
Applicazioni e Modalità d’uso
A seconda del mercato, l’area oggetto di target (salute gastro-intestinale o orale) e popolazione target, Lallemand Health Solutions aiuterà i distributori a sviluppare e produrre formulazioni di probiotici specifiche in forme di dosaggio adeguate, come capsule, bustine, stick orodispersibili, polvere in bustine come collutori, etc…
Formulazioni
Offriamo la possibilità di formulare specifiche combinazioni di lievito S.cerevisiae boulardii con diversi ceppi batterici per applicazioni mirate per la salute orale e intestinale. Grazie allo screening sistemico in vitro ed alla caratterizzazione dei nostri ceppi, Lallemand Health Solutions può aiutare i suoi clienti a selezionare i ceppi corretti per formulazioni esclusive e su misura.
Conclusioni
Le possibilità offerte dalla complementarietà di lieviti e batteri nei supplementi probiotici non sono mai state esplorate approfonditamente in precedenza, forse perché la selezione e la produzione industriale di lievito e batteri sono due processi differenti e la maggior parte dei produttori di probiotici sono specializzati nell’uno o nell’altro. Lallemand Health Solutions, esperta sia di lievito che di produzione e applicazioni di batteri, possiede la conoscenza e l’esperienza per sviluppare formulazioni probiotiche specifiche che combinano S.boulardii di grado farmaceutico con specifici batteri probiotici. La società ha selezionato una gamma di ceppi batterici ben documentati da combinarsi con S.boulardii per trattare la salute digestiva, dalla bocca all’intestino, con un nuovo approccio olistico.
Bibliografia
1 Sherman PM, Johnson-Henry KC, Yeung HP, Ngo PS, Goulet J, Tompkins TA (2005) Probiotics reduce enterohemorrhagic Escherichia coli O157:H7 and enteropathogenic E.coli O127:H6-induced changes in polarized T84 epithelial cell monolayers by reducing bacterial adhesion and cytoskeletal rearrangements. Infect Immun 73(8):5183-5188
2 Bisson JF, Hidalgo S, Rozan P, Messaoudi M (2009) Preventive effects of different probiotic formulations on travelers’ diarrhea model in wistar rats. Dig Dis Sci 55(4):911-919
3 Grandy G, Medina M, Soria R, Terán CG, Araya M (2010) Probiotics in the treatment of acute rotavirus diarrhoea. A randomized, double-blind, controlled trial using two different probiotic preparations in Bolivian children. BMC Infect Dis 10:253
4 Jindal G, Pandey RK, Agarwal J, Singh M (2011) A comparative evaluation of probiotics on salivary mutans streptococci counts in Indian children. Eur Arch Paediatr Dent 12:211-215
5 Jothika M, Vanajassun PP, Someshwar B (2015) Effectiveness of probiotic, chlorhexidine and fluoride mouthwash against Streptococcus mutans – randomized, single-blind, in vivo study. J Int Soc Prev Community Dent 5(Suppl 1):S44–S48
6 Thakkar PK, Imranulla M, Naveen Kumar PG, Prashant GM, Sakeenabi B, Sushanth VH (2013) Effect of probiotic mouthrinse on dental plaque accumulation: a randomized controlled trial. Dent Med Res 1:7-12
7 Purunaik S, Thippeswamy HM, Chavan SS (2014) To evaluate the effect of probiotic mouthrinse on plaque and gingivitis among 15-16 year old school children of Mysore City, India – randomized controlled trial. Global Journal of Medical Research: Journal of Dentistry and Otolaryngology 14 Issue 4 Version 1.0


